Investigador del Instituto Milenio en Inmunología e Inmunoterapia encabezó un estudio que demuestra que el HDL oxidado es capaz y suficiente para promover la fibrosis endotelial, generando hiperpermeabilidad vascular y aumento del riesgo de muerte en pacientes con shock séptico. “Se ha demostrado que el HDL oxidado tiene una función antagónica al HDL nativo”.
El académico añade que “hay suficiente evidencia para implementar mediciones de ‘colesterol bueno’ oxidado en orden a determinar la condición clínica de personas enfermas o sanas; lo cual podría ser incorporado al panel del perfil bioquímico que se aplica a grupos de riesgo y a toda persona en general”.
Un estudio dirigido por el doctor Felipe Simón, investigador del Instituto Milenio en Inmunología e Inmunoterapia (IMII), determinó que el llamado “colesterol bueno”, cuando se oxida, genera fibrosis endotelial, afectando la regulación de la presión arterial y contribuyendo al aumento de la mortalidad en pacientes con shock séptico.
El trabajo fue publicado en Antioxidants en diciembre de 2022 y en él participaron seis científicos, incluyendo cinco participantes actuales del IMII https://www.mdpi.com/2076-3921/11/12/2469, así como en la revista Thrombosis Research https://www.thrombosisresearch.com/article/S0049-3848(23)00014-2/fulltext; en enero 2023, en el cual participan siete miembros del IMII, y en otro artículo también en Antioxidants en febrero de 2023 https://www.mdpi.com/2076-3921/12/3/543, en el cual participan seis miembros del IMII, todos liderados por el doctor Simon.
EL “BUENO” Y EL “MALO”
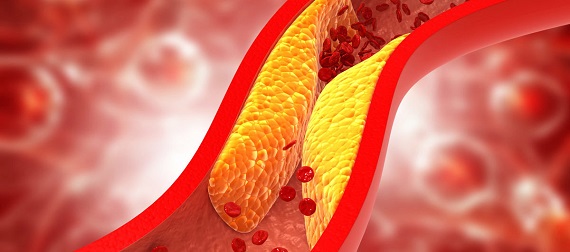
Las lipoproteínas circulan en el torrente sanguíneo cumpliendo variadas funciones. Las principales son la de baja densidad (LDL), conocida como “colesterol malo”, y la de alta densidad (HDL), coloquialmente llamada “colesterol bueno”. Mientras las LDL están relacionadas con disfunciones vasculares, las HDL son un reconocido factor vascular protector que confiere una defensa contra patologías como la enfermedad arterial coronaria y la aterosclerosis.
Pero las HDL pueden oxidarse debido a que, durante la inflamación sistémica, se generan especies reactivas del oxígeno (ROS) en el torrente sanguíneo, lo que produce grandes cantidades de “colesterol bueno” oxidado. Este pierde las características vasculares de las HDL nativas, adquiriendo acciones perjudiciales, según se expone en los artículos publicados recientemente.
El endotelio es un tejido conformado por células que recubren el interior de venas, arterias y capilares. Participa en la regulación de la contractilidad vascular, regula la permeabilidad, controla la coagulación sanguínea y participa en la generación de nuevos vasos.
“Las HDL ejercen sus efectos protectores al interactuar con las células endoteliales para desencadenar la señalización intracelular que apoya las funciones endoteliales, incluida la preservación de la permeabilidad vascular y la integridad del endotelio”, dice el trabajo publicado por el grupo de científicos.
“Las condiciones inflamatorias sistémicas provocan un aumento del entorno oxidativo en el torrente sanguíneo mediado por la generación de especies reactivas del oxígeno (ROS). Por lo tanto, durante inflamación sistémica, las ROS circulantes interactúan con las macromoléculas plasmáticas circulantes, promoviendo la modificación oxidativa. Así, las lipoproteínas son altamente oxidadas en el torrente sanguíneo a través de modificaciones mediadas por las reacciones desencadenadas por ROS y enzimas oxidativas activadas por ROS”, indican los artículos, donde se agrega que “las HDL son más susceptibles a la oxidación que otras lipoproteínas, por lo que se genera una gran cantidad de HDL oxidada”. De este modo, el colesterol bueno oxidado contribuye a la disfunción endotelial.
SISTEMA VASCULAR
Los estudios llevados a cabo por el doctor Simón, profesor de la Universidad Andrés Bello, y académicos de las universidades de Chile y Pontificia Universidad Católica de Chile, principalmente, tuvo por objetivo investigar el efecto deletéreo del HDL oxidado sobre el endotelio, dilucidar el mecanismo molecular y celular subyacente, y determinar sus consecuencias sobre la permeabilidad vascular y su asociación con la mortalidad.
“Una forma de aproximarse a la condición de septicemia es poner foco en el sistema vascular. Los vasos sanguíneos recorren todo el cuerpo y llevan nutrientes hacia los órganos; ingresan a través de la red capilar y eliminan componentes y desechos como el dióxido de carbono”, explica Simón, doctor en ciencias biomédicas.
“La red vascular está integrada con la función de los órganos. En su capa interior, tiene células endoteliales, que es una monocapa de células muy fina y da la cara al torrente sanguíneo, por lo que interactúa ineludiblemente con moléculas y agentes patogénicos circulantes”, indica el profesor de la Universidad Andrés Bello.
Dicho tejido endotelial -afirma Simón- “se visualiza como un tejido del sistema inmunitario, pues tiene receptores para detectar patógenos y es capaz de montar respuestas inmunitarias”.
“Hace unos diez años -prosigue-, se detectó un proceso en las células endoteliales mediante el cual se cambia el programa de expresión de genes endoteliales, que hace que aquellas se conviertan en otro tipo de células de características fibróticas, la transición endotelio-mesenquimática. Esta transición es estimulada fuertemente a través del proceso inflamatorio. Entonces las células endoteliales pierden sus características y actúan como fibroblasto”.
El fibroblasto es un tipo de células que contribuye a la formación de tejido de soporte. Los fibroblastos secretan colágeno y otras proteínas que ayudan a mantener el marco estructural de los tejidos u órganos del cuerpo, al mismo tiempo que apoya funciones celulares.
“Lo que sucede -sostiene el investigador del IMII- es muy importante pues significa que, durante la inflamación sistémica, como la que sucede en la septicemia, nuestras células endoteliales se convertirán en un tipo celular diferente. Esto podría explicar la disfunción que ocurre en los vasos sanguíneos durante una septicemia, en particular la deficiente perfusión, es decir, que no se suministre suficiente sangre a los órganos”.
Ello se ha observado tanto en plataformas de trabajo in vitro, como también en plasma de animales y de pacientes. “El endotelio deja de funcionar como tal, lo que es un proceso relevante en el transcurso de la septicemia y está ya bastante documentado”, dice Felipe Simón.
“Los fibroblastos son parte constituyente del organismo y cumplen funciones relevantes. Lo nocivo es que una célula, en este caso una célula endotelial, pierda sus funciones y, por tanto, deje de funcionar como debe hacerlo para adquirir propiedades fibróticas. Por ejemplo, en la retina tenemos células que detectan la luz, las células fotorreceptoras que nos permiten observar las cosas. Si dejaran de hacer eso, y se convirtieran en otro tipo de células, tendríamos otras capacidades diferentes en la retina, pero no de percibir colores ni formas. He ahí lo relevante: la célula se convierte en una de otro tipo. Mientras el fibroblasto tiene funciones de sostén y de cicatrización por ejemplo, el endotelio tiene un rol mucho más específico; entonces, que se convierte en fibroblasto es perjudicial porque hay menos células desempeñando la función endotelial que necesitamos”, advierte el académico.
PUBLICACIONES
En cuanto al estudio encabezado por el investigador del Instituto Milenio en Inmunología e Inmunoterapia, aquel implicó analizar muestras de sangre de pacientes admitidos en una unidad de cuidados intensivos (UCI), así como ratas endotoxémicas y cultivos celulares endoteliales expuestos a lipopolisacárido. Se incluyeron pacientes de ambos sexos mayores de 18 años. Además, se incluyeron voluntarios sanos que sirvieron como grupo control.
“En los artículos hablamos de la condición patológica denominada septicemia, o shock séptico, que se caracteriza por la presencia de una infección en el torrente sanguíneo; significa que hay patógenos en la sangre. Es una condición grave porque conlleva a un estado inflamatorio global del paciente y viene unida con la disfunción de órganos, incluyendo falla renal, disfunción respiratoria, entre otras complicaciones, lo que aumenta la probabilidad de muerte”, plantea Simón.
“Los estados inflamatorios sistémicos agudos graves, como los que se dan en pacientes críticos ingresados en la UCI, se caracterizan por graves alteraciones vasculares. Los pacientes de las UCI presentan hiperpermeabilidad endotelial asociada a una extensa formación de edema, lo que favorece la hipoperfusión de los órganos contribuyendo decisivamente en la muerte”, se indica en el artículo divulgado en Antioxidants.
En general, el síndrome séptico en conjunto, desde casos leves a severos, genera una mortalidad del 20 al 30% en Chile. Las condiciones más severas, desde luego, hacen que la mortalidad aumente. “No es un porcentaje particularmente distinto al que se observa en Europa y Estados Unidos, lo que indica que nuestras UCI están a un muy buen nivel de capacitación y tecnología”, apunta el investigador del IMII. “El índice de mortalidad sí aumenta en varios países de África, Asia y algunos sudamericanos, con poco desarrollo en el campo de la medicina”.
El éxito al tratar casos de septicemia se sostiene en la calidad de la medicina y de las UCIs. “Cuando ocurre una infección en el torrente sanguíneo, la persona es hospitalizada, pero actualmente no hay un tratamiento realmente efectivo, entendido como un fármaco, una droga, o un procedimiento con el cual obtengamos un muy elevado porcentaje de sobrevivencia. Lo que existe es un protocolo de tratamiento en el cual se usan antibióticos de amplio espectro, antiinflamatorios de diverso tipo además de agentes vasoactivos, se practica la incorporación de volumen resucitación para mantener la presión arterial, además de otros procedimientos. Sin embargo, a pesar de la tecnología de punta que se usa para mantener a un paciente con septicemia, los cuidados que se tienen y los recursos económicos que se destinan, estos procedimientos se observan como insatisfactorios”, expone Felipe Simón.
“Nos falta mucho por conocer y entender en cuanto a los mecanismos que subyacen en el desarrollo de la septicemia, para así lograr tratamientos altamente efectivos, que permitan acercarnos al cien por ciento de pacientes sobrevivientes tras una septicemia”, dice el académico.
ESTRÉS OXIDATIVO
Simón comenta que uno de los factores que produce la transformación de endotelio a fibroblasto es la presencia de estrés oxidativo, que es una característica típica de una inflamación de cualquier tipo. “Cada vez que hay inflamación, por ejemplo, si nos hacemos una herida o nos quemamos o golpeamos un dedo, hay producción de estrés oxidativo, y esto también se da en la septicemia, pero a una escala de mucho mayor magnitud. Esto estimula la conversión del endotelio a fibroblasto y, asimismo, oxida las proteínas del torrente sanguíneo, siendo una de ellas el HDL (‘colesterol bueno’), que en su forma nativa lleva el colesterol hacia el hígado y lo retira desde nuestro torrente sanguíneo, y mantiene el colesterol en baja concentración. Es un muy buen protector vascular, previene la trombosis; es una molécula que conviene tener en niveles normales”, dice el investigador.
“En el estrés oxidativo, se oxidan proteínas del torrente sanguíneo, incluyendo el ‘colesterol bueno’, transformándolo en HDL oxidado, que es una molécula distinta y deja de tener propiedades de HDL beneficioso. Ese HDL oxidado ya no es protector vascular, es más bien favorecedor de trombosis. Asimismo, no es mantenedor de la integridad endotelial y transforma el endotelio en fibroblasto. En los artículos, entonces, demostramos estas dos cosas: el HDL oxidado promueve dicha conversión, así como la actividad protombótica, esto último porque vuelve la red vascular más susceptible de generar trombos”.
“Por eso creemos que el HDL oxidado debería ser vigilado tanto como el HDL nativo. Normalmente los exámenes que se practican a las personas de manera rutinaria miden cambios en el nivel plasmático del HDL, pero no el nivel del HDL oxidado, que a nuestro juicio debe ser también evaluado pues proporciona información sobre el grado de inflamación y estrés oxidativo asociado con la función vascular”, sostiene Simon.
En el artículo se afirma que “dilucidar los mecanismos celulares y moleculares subyacentes que intervienen en la disfunción endotelial vascular mediada por el estrés oxidativo e investigar su impacto en la disfunción y muerte de órganos es crucial para mejorar el tratamiento de las enfermedades inflamatorias sistémicas”.
Como plantean los investigadores, “este es el primer estudio que demuestra que el HDL oxidado es capaz y suficiente para promover la fibrosis endotelial, generando hiperpermeabilidad, hipotensión y aumento del riesgo de muerte. En particular, la inhibición de la fibrosis endotelial y el consumo de dieta antioxidante protegen contra el aumento de los niveles de HDL oxidado, preservando la presión arterial normal, manteniendo la permeabilidad de tejidos y órganos, y aumentando la supervivencia”.
“Se ha demostrado que el HDL oxidado tiene una función antagónica al HDL nativo. Lo segundo es que hay suficiente evidencia para comenzar las mediciones de ‘colesterol bueno’ oxidado en orden a determinar la condición clínica de personas enfermas o sanas; debería ser incorporado al panel de mediciones del perfil bioquímico que se aplica a grupos de riesgo y a toda persona en general”, sostiene el doctor Simón.
“El consumo de antioxidantes, que están presentes en frutos rojos y secos, algunas legumbres y otros alimentos, sin duda tiene una fuerte asociación con la protección vascular y cardiovascular. Lo que se desconoce es en qué dosis y frecuencia tiene efectos positivos para la prevención y el tratamiento de enfermedades que presentan generación de estrés oxidativo”, concluye el investigador.